
-
 29 September 2012
Биология
29 September 2012
Биология
- Автор: Dashunikis
Какой объем оксида углерода (4) выделиться при обжиге известняка массой 1 кг с массовой долей примесей 20%?
-
-

-
 29 September 2012
29 September 2012
- Ответ оставил: Makskorolev99
1. Запишем уравнение реакции:
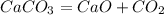
2. Вычислим массу чистого карбоната кальция (известняка): если в нем 20% примесей, то чистого вещества - 80%, массу мы получим, умножив массу известняка на массовую долю чистого вещества: 1000гр*80% = 800 гр.
3. Вычислим количество вещества известняка, для этого его массу разделим на молярную массу: 800/100=8моль.
4. Из уравнения реакции видно, что количество вещества CaCO3 и CO2 равны, то есть из одного моля CaCO3 мы получим 1моль CO2, а из 8 - 8 :)
5. 1 моль любого газа занимает при стандартных условиях объем 22,4 л. Соответственно 8 моль займут объем 8*22,4=179,2 литра.
Ответ: 179,2 литра
-
-

- НЕ НАШЛИ ОТВЕТ?
Если вас не устраивает ответ или его нет, то попробуйте воспользоваться поиском на сайте и найти похожие ответы по предмету школьной программы: биология.
На сегодняшний день (22.12.2025) наш сайт содержит 239971 вопросов, по теме: биология. Возможно среди них вы найдете подходящий ответ на свой вопрос. -
Нажимая на кнопку "Ответить на вопрос", я даю согласие на обработку персональных данных
Ответить на вопрос



